Сколько серной кислоты (H2SO4) (в т) может быть получено из 36 т пирита FeS2.
Решение задачи
Процесс получения серной кислоты (H2SO4) из пирита (FeS2) протекает по следующим стадиям:
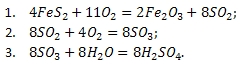
Запишем суммарное уравнение реакции:
![]()
Хочу обратить ваше внимание на то, что если образование продукта, массу которого необходимо определить, идет через ряд промежуточных стадий, не целесообразно проводить расчет по каждой стадии. В таких случаях для расчета составляем стехиометрическую схему, которая включает исходный и конечный продукты с учетом их стехиометрических коэффициентов.
Решение по стехиометрической схеме нельзя применять в том случае, если исходное вещество расходуется на образование не только основного, но и побочных продуктов реакции.
Итак, вернемся к решению задачи. Из процесса получения серной кислоты, мы видим, что вся содержащаяся в пирите (FeS2) сера расходуется на образование серной кислоты (H2SO4). Из суммарного уравнения реакции следует, что из 1 моль пирита (FeS2) образуется 2 моль серной кислоты (H2SO4), что позволяет составить схему стехиометрического процесса:
![]()

Рассчитаем молярные массы пирита (FeS2) и серной кислоты (H2SO4):
M (FeS2) = 56 + 2 ∙ 32 = 120 (г/моль).
M (H2SO4) = 2 + 32 +4 ∙ 16 = 98 (г/моль).
Учитывая, что молярные массы пирита (FeS2) и серной кислоты (H2SO4) соответственно равны 120 и 98 г/моль, воспользуемся стехиометрической схемой для проведения расчета:
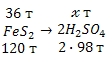
из 120 т FeS2 можно получить 196 т H2SO4
из 36 т FeS2 можно получить ![]() т H2SO4
т H2SO4
Откуда:
![]()
Ответ: 58,8 т серной кислоты.
