Как рассчитать массу газообразного водорода (H2), который выделится, если растворить 2,7 грамма алюминия в соляной кислоте (HCl)?
Решение задачи
Составим уравнение реакции растворения алюминия в соляной кислоте (HCl):
![]()
Учитывая, что молярная масса алюминия (Al) равна 27 г/моль, а молярная масса водорода (H2) равна 2 г/моль по уравнению реакции рассчитаем, сколько моль водорода (H2) образуется в ходе реакции:
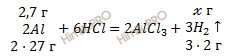
2,7 г алюминия в соляной кислоте вытесняет х г H2
54 г алюминия в соляной кислоте вытесняет 6 г H2
Откуда:
![]()
Ответ:
масса газообразного водорода 0,3 грамма.

Исправьте или поясните почем так:
1.
n (Cu) = 12,8/63,5 = 0,2 (моль).
——————————
Это зачем посчитали? нигде более не используется.
2.По уравнению реакции рассчитаем, сколько моль сернистого газа (SO2) образуется в ходе реакции:
Причем тут диоксид серы?
По заданию у нас тока алюминия в соляной кислоте, и все!
Да, действительно, вышла ошибочка, лишнее удалено.
Спасибо за комментарий