В результате спиртового брожения виноградного сахара, содержащего 20% несахаристых примесей, выделилось 138 грамм спирта. Сколько виноградного сахара подвергалось реакции спиртового брожения? Какой объем углекислого газа (CO2) выделился при этом?
Решение задачи
Виноградный сахар, то же что и глюкоза, встречается в соке многих фруктов и ягод, в том числе и винограда, от чего и произошло название. Виноградный сахар, является шестиатомным сахаром (гексозой). Формула С6H12O6.
Запишем уравнение реакции спиртового брожения виноградного сахара:
![]()
Учитывая, что молярные массы этанола (C2H5OH) и виноградного сахара (С6H12O6) соответственно равны 46 г/моль, 180 г/моль (смотри таблицу Менделеева), по уравнению реакции спиртового брожения найдем массу чистого виноградного сахара (С6H12O6) и объем углекислого газа (CO2):
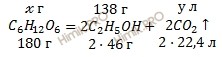
х г С6H12O6 участвует в образовании 138 г C2H5OH
180 г С6H12O6 участвует в образовании 92 г C2H5OH
Откуда:
![]()
Следовательно, реакции спиртового брожения подверглось 270 г виноградного сахара.
Так как, виноградный сахар содержит 20% (100% — 20% = 80% — массовая доля виноградного сахара без примесей) несахаристых примесей, найдем всю массу виноградного сахара по формуле:
![]()
Получаем:
m (С6H12O6) = 270 / 0,8 = 337,5 (г).
Если виноградный сахар 80%, то массовая доля в нем 0,8.
Рассчитаем объем углекислого газа (CO2) по уравнению реакции спиртового брожения :
270 г C2H5OH участвует в образовании у л CO2
180 г C2H5OH участвует в образовании 44,8 л CO2
Откуда:
![]()
Следовательно, выделился углекислый газ (CO2) объемом 67,2 л.
Ответ:
реакции подвергалось 337,5 грамм виноградного сахара;
объем углекислого газа 67,2 литра.
