Рассчитайте константу гидролиза хлорида аммония ( NH4Cl ), КД (NH4OH) = 1,77 ⋅ 10-5.
Решение задачи
Напомню, что константа гидролиза (Кгидр) характеризует способность соли подвергаться гидролизу. Чем больше константа гидролиза, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз.
Для расчета константы гидролиза (Кгидр) соли слабого основания и сильной кислоты вычисляют по формуле:
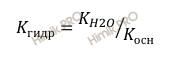
Где:
Косн – константа диссоциации слабого основания.
Соответственно, константа гидролиза хлорида аммония (NH4Cl) равна:
Кгидр (NH4Cl) = 10-14 /1,77 ⋅ 10-5 = 5,65 ⋅ 10-10.
Ответ:
константа гидролиза равна 5,65 ⋅ 10-10.
