Вычислить степень диссоциации (α) и равновесную концентрацию ионов водорода ([H+]) в 0,1 М растворе хлорноватистой кислоты (HClO). Константа диссоциации составляет 5 ∙ 10-8. Как изменится равновесная концентрация ионов водорода ([H+]), если к 1 литру 0,1 М раствора хлорноватистой кислоты (HClO) добавить 0,2 моля гипохлорита натрия (NaClO)?
Решение задачи
Перед тем как решить предложенную задачу и вычислить степень диссоциации, думаю, следует напомнить, что степень диссоциации слабого электролита резко снижается при добавлении к нему сильного электролита с одноименным ионом. Если в растворе слабого электролита , диссоциирующего по схеме:
увеличить концентрацию H+-ионов за счет прибавления сильной кислоты или концентрацию ионов A— за счет прибавления соли этой кислоты, это приведет к сдвигу равновесия влево, то есть к уменьшению относительного количества диссоциированных молекул электролита.
Запишем уравнение диссоциации хлорноватистой кислоты (HClO):
![]()
Найдем равновесную концентрацию ионов водорода ([H+]) по формуле:
![]()
Вычислим степень диссоциации хлорноватистой кислоты (HClO), используя формулу вычисления степени диссоциации:
![]()
Если к 1 л раствора хлорноватистой кислоты (HClO) добавить 0,2 моля гипохлорита натрия (NaClO), то концентрация ионов водорода (H+) уменьшится за счет увеличения концентрации ионов ClO—.
Запишем уравнение диссоциации гипохлорита натрия (NaClO):
![]()
Обозначим концентрацию ионов водорода (H+) через х, тогда концентрация ионов ClO— будет равна:
х + αClO— (αClO— – активность ионов ClO—, образовавшихся при диссоциации гипохлорита натрия (NaClO)).
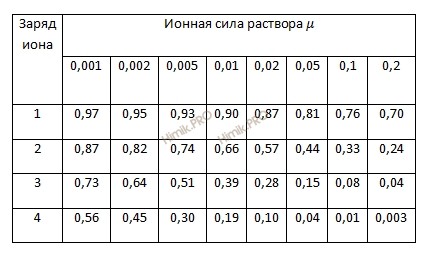
Из таблицы 1 находим, что для 0,2 раствора гипохлорита натрия (NaClO) (µ = 0,2) коэффициент активности ионов ƒ = 0,7, а αClO— составит 0,14 моля (0,2 ∙ 0,7).
Таблица 1. Приближенные значения средних коэффициентов активности (ƒ) в зависимости от ионной силы (µ) раствора и заряда иона
Подставим эти величины в выражение для константы диссоциации:
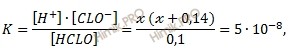
откуда:
х2 + 0,14х = 5 ⋅ 10-9.
Так как х2 величина очень маленькая, для упрощения вычислений пренебрегаем ею, тогда:
0,14х = 5 ⋅ 10-9
х = 3,6 ⋅ 10-8 (моль/л).
Найдем во сколько раз уменьшилась равновесную концентрацию ионов водорода ([H+]), а следовательно и степень диссоциации:
![]()
Ответ:
степень диссоциации равна 0,07 % или 7 ⋅ 10-4 моль/л;
равновесная концентрация ионов водорода равна 7 ⋅ 10-5 моль/л;
равновесная концентрация ионов водорода уменьшится в 1950 раз.
