Вычислить pH раствора, если к 3 литрам воды прибавили 2 миллилитра 96-процентной серной кислоты (H2SO4), плотность которой 1,84 г/см3.
Решение задачи
Запишем уравнение диссоциации серной кислоты:
![]()
Вычислим массу 2 мл 96-процентного раствора серной кислоты (H2SO4) по формуле:
![]() Получаем:
Получаем:
m (р-ра H2SO4) = 1,84 г/см3 ∙ 2 см3 = 3,68 (г).
Найдем, сколько в растворе содержится серной кислоты (H2SO4) (в г). Для расчета будем использовать формулу нахождения массовой доли растворенного вещества в растворе:
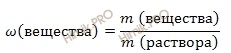
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Откуда выразим массу вещества:
![]()
Получаем:
![]()
Если раствор 96-процентный, то массовая доля серной кислоты (H2SO4)в нем 0,96.
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, рассчитаем химическое количество серной кислоты (H2SO4) в растворе, используя формулу, которая устанавливает связь между химическим количеством вещества и массой:
![]()
Получаем:
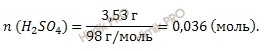
Учитывая, что объем раствора после добавления к воде серной кислоты (H2SO4) равен 3,002 л (3 л + 0,002 л), найдем молярную концентрацию раствора серной кислоты (H2SO4) по формуле:
![]()
Молярная концентрация показывает количество растворенного вещества (моль), содержащегося в 1 л раствора.
Получаем:

По уравнению диссоциации вычислим, сколько моль ионов водорода (H+)образуется при полной диссоциации 0,012 моль раствора серной кислоты (H2SO4):

при диссоциации 1 моль H2SO4 образуется 2 моль ионов H+
при диссоциации 0,012 моль H2SO4 образуется ![]() моль ионов H+
моль ионов H+
Откуда:
![]()
Следовательно, концентрация ионов водорода ([H+]) равна 0,024 моль.
Вычислим pH раствора серной кислоты (H2SO4):
![]()
![]()
![]()
Ответ: pH = 1,62.

у вас всё красиво получилось потому что дано было ооочень много кислоты, а представьте, что её было не 1.2*10^-2 моль/л, для которой такое приближение более менее работает, а скажем 5*10^-8 (10^-7 H+) и вот в таком случае вы получите -lg(10^-7)=7, то есть по вашей логике среда нейтральная, хотя на деле она кислая 🙂
Спасибо за комментарий! Задача решена верно, исходя из условия
В связи с первым комментарием у меня возникла мысль, что под знак логарифма необходимо ввести и количество ионов водорода (H+) воды, так как их общее число мы определяем в растворе. Тогда не возникнет казуса с добавлением очень малого количества серной кислоты в раствор и PH всегда будет меньше 7. Химию я изучал очень много лет назад в школе, на этот сайт зашёл случайно, так что не судите строго, могу ошибаться.
Спасибо за комментарий!
Огромное спасибо за решение задачи, прямо все разложили по полочкам, очень помогло + понял метод ее решения. Еще раз спасибо!
Всегда рада помочь!