В 500 миллилитрах раствора содержится 12 грамм фосфорной кислоты (H3PO4). Найти молярную концентрацию и молярную концентрацию эквивалента фосфорной кислоты для реакции образования гидрофосфата натрия (Na2HPO4).
Решение задачи
Запишем уравнение реакции образования гидрофосфата натрия (Na2HPO4), происходит путём нейтрализации разбавленной фосфорной кислоты разбавленным раствором едкого натра (NaOH):
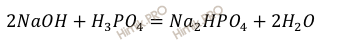
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
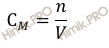
Найдем молярную концентрацию фосфорной кислоты (H3PO4) в 500 мл раствора с массой 12 грамм. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
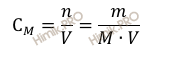
где:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора.
Учитывая, что молярная масса фосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Д.И. Менделеева), получаем, что молярная концентрация фосфорной кислоты (H3PO4) равна:
CM (H3PO4) = 12/ 98 ∙ 0,5 = 0,2 (моль/л).
Напомню, что под молярной концентрацией эквивалента понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «N».
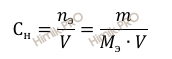
Найдём молярную массу эквивалента фосфорной кислоты (H3PO4) по формуле:
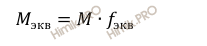
Напомню то, что молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Фактор эквивалентности (fэкв)– число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Фактор эквивалентности и эквивалентная масса вещества определяются той реакцией в которой данное вещество принимает участие, так как у одного и того же вещества в различных реакциях различны фактор эквивалентности и эквивалентная масса.
Учитывая, что молярная масса молярная масса фосфорной кислоты (H3PO4) равна 98 г/моль и в реакции нейтрализации принимает участие 2 иона водорода (2H+), получаем:
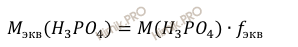
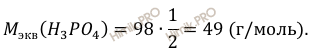
Найдём молярную массу эквивалента фосфорной кислоты (H3PO4):
CН (H3PO4) = 12/ 49 ∙ 0,5 = 0,5 (моль-экв/л).
Ответ:
молярная концентрация фосфорной кислоты (H3PO4) равна 0,2 моль/л;
молярная масса эквивалента фосфорной кислоты (H3PO4) равна 0,5 моль-экв/л.
