Какой объем водорода (H2) (н.у) при действии избытком цинка (Zn) на 100 грамм 4,9- процентного раствора серной кислоты (H2SO4).
Решение задачи
Составим уравнения реакции взаимодействия цинка (Zn) с раствором серной кислоты (H2SO4):
![]()
Для решения задачи используем формулу, нахождения массовой доли вещества:
![]()
Выразим из формулы m (вещества):
![]()
Получаем:
m (H2SO4) = 100 ∙ 0,049 = 4,9 (г).
Если раствор серной кислоты (H2SO4) 4,9-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,049.
Найдем химическое количество серной кислоты (H2SO4) по формуле, устанавливающей связь между химическим количеством вещества и массой:
![]()
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль получаем:
n (H2SO4) = 4,9 / 98 = 0,05 (моль).
По уравнению реакции рассчитаем, сколько моль водорода (H2) образуется в ходе реакции:
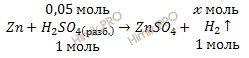
при участии 0,2 моль H2SO4 образуется ![]() моль H2
моль H2
при участии 1 моль H2SO4 образуется 1 моль H2
Откуда:
![]()
Найдем какой объем водорода (H2) образуется при действии избытком цинка (Zn) на раствор серной кислоты (H2SO4) по формуле, устанавливающей связь между объемом и химическим количеством вещества:
![]()
Получаем:
V (H2) = 0,05 ∙ 22,4 = 1,12 (л).
Ответ:
какой объем водорода – равно 1,12 литра.
