Кислота мрамор. Вычислите объем углекислого газа (CO2), который можно получить из мрамора и 200 грамм раствора азотной кислоты (HNO3), массовая доля кислоты в котором 0,63.
Решение задачи
Напомню, что основу химического состава мрамора составляет кальцит – одна из природных форм карбоната кальция (CaCO3).

Кислота мрамор. Запишем уравнение реакции действия азотной кислоты (HNO3) на мрамор:
![]()
Найдем, сколько в растворе содержится азотной кислоты (HNO3) (в г). Для расчета будем использовать формулу нахождения массовой доли растворенного вещества в растворе:
![]()
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %.
Откуда выразим m (вещества):
![]()
Получаем:
m (HNO3) = 200 ∙ 0,63 = 126 (г).
Учитывая, что молярная масса азотной кислоты (HNO3) равна 63 г/моль (смотри таблицу Менделеева), найдем химическое количество азотной кислоты (HNO3) по формуле, устанавливающей связь между химическим количеством вещества и массой:
![]()
Получаем:
n (HNO3) = 126 /63 = 2 (моль).
По уравнению реакции найдем химическое количество углекислого газа (CO2), который выделяется в ходе реакции:
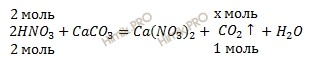
при действии 2 моль HNO3 образуется х моль CO2
при действии 2 моль HNO3 образуется 1 моль CO2
Откуда:
![]()
Кислота мрамор. По формуле, устанавливающей связь между химическим количеством вещества и объемом, рассчитаем объем углекислого газа (CO2), который образуется в ходе реакции:
![]()
Получаем:
V (CO2) = 1 ∙ 22,4 = 22,4 (л).
Ответ:
объем углекислого газа 22,4 литра.
