Термохимическое уравнение горения алюминия имеет вид:
Al + О2 = Al2O3 + 3350 кДж.
В результате реакции выделилось 502,5 кДж теплоты. Сколько граммов алюминия вступило в реакцию? Ответ округлите до десятых.
Решение задачи
Запишем термохимическое уравнение горения алюминия:
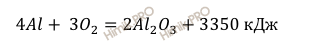
В условии задачи сказано, что в результате реакции горения алюминия выделилось 502,5 кДж теплоты. Учитывая, что молярная масса алюминия (Al) равна 27 г/моль (смотри таблицу Менделеева), найдём по уравнению реакции горения алюминия какая масса алюминия вступила в реакцию:
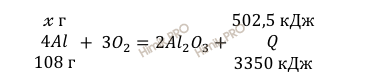
при сгорании х г Al выделяется 502,5 кДж энергии
при сгорании 108 г Al выделяется 3350 кДж энергии
Откуда:

В реакцию горения алюминия вступило 16,2 г алюминия (Al).
Ответ:
16,2 грамма алюминия вступило в реакцию горения алюминия.
