При электролизе хлорида водного раствора хлорида натрия (NaCl) образовалось 56 грамм гидроксида натрия (NaOH). Какие газы выделились и каков их объем? Электролиз хлорида
Решение задачи
По условию задачи протекает электролиз хлорида раствора хлорида натрия (NaCl). Учитывая, что раствор соли хлорида натрия (NaCl), образован активным металлом натрием (Na) и бескислородным кислотным остатком (Cl—), рассмотрим механизм электролиза хлорида (NaCl).
Запишем уравнение диссоциации электролита:
![]()
Катионы активного металла не восстанавливаются, а идет восстановление молекул воды (H2O). Процесс, протекающий на катоде (-) при электролизе хлорида:
![]()
![]()
Процесс, протекающий на аноде (+) при электролизе хлорида:
![]()
![]()
Запишем ионно-молекулярное уравнение электролиза хлорида:
![]()
На основании ионно-молекулярное уравнения составим молекулярное уравнение электролиза хлорида:
![]()
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита и сопровождающийся разложением расплавленного или растворенного вещества или воды.
Зная, что молярная масса гидроксида натрия (NaOH) равна 40 г/моль (смотри таблицу Менледеева), найдем химическое количество гидроксида натрия (NaOH), который образовался при электролизе. Для этого будем использовать формулу нахождения химического количества вещества через массу:
![]()
Получаем:
n (NaOH) = 56 /40 = 1,4 (моль).
По уравнению реакции электролиза хлорида (NaCl) найдем, сколько водорода (H2) и хлора (Cl2) выделилось:
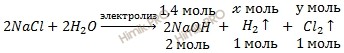
Откуда:
![]()
Откуда:
![]()
По формуле, устанавливающей связь между объемом и химическим количеством вещества:
![]()
Найдем объем водорода (H2) и хлора (Cl2):
V (H2) = V (Cl2) = 0,7 ∙ 22,4 = 15,68 (л).
Ответ:
объем водорода (H2) равен 15,68 л;
объем хлора (Cl2) равен 15,68 л.
