При обработке 0,5 литров жесткой воды карбонатом натрия (Na2CO3) в осадок выпало 70 миллиграмм карбоната кальция (CaCO3). Какая жесткость воды, если она обусловлена только сульфатом кальция (CaSO4)?
Решение задачи
Запишем уравнение реакции устранения жесткости воды карбонатом натрия (Na2CO3):
![]()
Какая жесткость воды.
Найдем молярные массы веществ (смотри таблицу Менделеева):
M (CaSO4) = 40 + 32 + 4 ⋅ 16 = 136 (г/моль),
M (CaCO3) = 40 + 12 + 3 ⋅ 16 = 100 (г/моль).
По уравнению реакции найдем массу сульфата кальция (CaSO4):
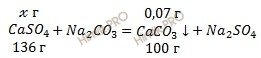
при обработке х г CaSO4 образуется 0,07 г CaCO3
при обработке 136 г CaSO4 образуется 100 г CaCO3
Откуда:
![]()
Какая жесткость воды. Вычислим молярную массу эквивалента сульфата кальция (CaSO4) по формуле:
![]()
Где:
z – число эквивалентности.
Получаем:
Mэкв. (CaSO4) = 136 / 2 = 68 (г/моль).
Какая жесткость воды. Запишем формулу нахождения жесткости воды:
![]()
Где:
Ж — жесткость воды, ммоль /л;
m — масса вещества, обусловливающего жесткость воды или применяемого для ее устранения, мг; Мэ — эквивалентная масса этого вещества, г/моль;
V — объем воды, л (дм3).
Подставляя в формулу данные из условия задачи, найдем какая жесткость воды:
Ж = 95,2 / 68 ⋅ 0,5 = 2,8 (ммоль /дм3).
Ответ:
жесткость воды 2,8 ммоль/дм3.
