Подожгли смесь, содержащую 0,6 моль водорода и 0,4 моль кислорода. Сколько грамм воды образовалось?
Решение задачи
Перед решением задачи, напомню, что вещества вступают в реакцию в определенных стехиометрических отношениях.
Если для реакции взяты вещества в отношениях, не соответствующих стехиометрическим, то одно из них окажется в избытке. Масса образовавшегося продукта определяется по массе исходного вещества, прореагировавшего полностью. Такие задачи относят к задачам на избыток-недостаток.
Напишем уравнение реакции горения водорода (H2):
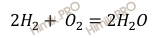
Из уравнения реакции горения водорода следует, что водород (H2) и кислород (O2) взаимодействуют в молярном отношении 2 : 1.
Найдем, какое из веществ, вступивших в реакцию горения водорода, дано в избытке, а какое – в недостатке. Для этого химическое количество веществ сопоставим с соотношением количеств этих веществ в уравнении реакции.
Сравниваем количество моль веществ и определяем недостаток. Получаем, что водород взят в недостатке (0,6 : 0,4 = 1 : 1,5).
Далее расчет проводим по водороду (Н2) – веществу, взятому в недостатке.
Согласно уравнению реакции горения водорода найдем, сколько моль воды образуется при участии 0,6 моль водорода (Н2):
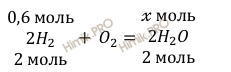
при взаимодействии 0,6 моль H2 с O2 образуется моль H2O
при взаимодействии 2 моль H2 с O2 образуется 2 моль H2O
Откуда:
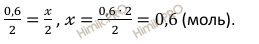
Рассчитаем массу воды (H2O), которая образуется при взрыве смеси водорода (H2) и кислорода (O2) по формуле:
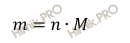
Рассчитаем молярную массу воды (H2O), смотри таблицу Менделеева:
M (H2O) = 2 + 16 = 18 (г/моль).
Получаем, масса воды в реакции горения водорода равна:
m (H2O) = 0,6 ∙ 18 = 10,8 (г).
Ответ:
образовалось 10,8 грамм воды.
