Вычислить степень диссоциации и равновесную концентрацию ионов водорода ([H+]) в 0,01 M растворе плавиковой кислоты (HF). Константа диссоциации составляет 6,8 ∙ 10-4.
Решение задачи
I способ решения (II способ)
Напоминаю, что предварительный выбор формул для вычисления степени диссоциации и ионов водорода ([H+]) равновесной концентрации зависит от отношения C/K В данном случае отношение C/K < 100.
Запишем уравнение диссоциации плавиковой кислоты (HF):
![]()
Учитывая, что отношение C/K < 100, то степень диссоциации плавиковой кислоты (HF) вычислим по формуле:
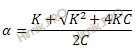
где:
α – степень диссоциации;
K – константа диссоциации;
C– общая концентрация электролита.
Подставим известные значения в формулу:

Найдем ионов водорода равновесную концентрацию:
![]()
Откуда:
[H+] = 0,01 ∙ 0,23 = 0,0023 (моль/л).Ответ:
степень диссоциации плавиковой кислоты равна 23%;
равновесная концентрация равна 0,0023 моль/л.
