Определите pH кислоты (0,17 нормальной уксусной кислоты (CH3COOH)), константа диссоциации которой равна 1,75 ⋅ 10-5.
Решение задачи
Константа и степень диссоциации слабого электролита связаны между собой соотношением:
![]()
где:
α – степень диссоциации;
K – константа диссоциации;
C– общая концентрация электролита.
Определить pH кислоты
Получаем:
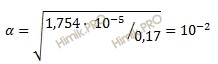
Определяем концентрацию ионов водорода [H+]:
[H+] = 0,17 ⋅ 1 ⋅ 10-2 = 0,17 ⋅ 10-2 (моль/л).Определим pH кислоты (CH3COOH) по формуле:
![]()
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
Получаем:
pH (CH3COOH) = -lg 0,17 ⋅ 10-2 = 2,77.
Ответ:
водородный показатель раствора 2,77.
