Вычислите концентрацию ионов натрия (Na+) (в моль/л) в 1,17-процентном растворе хлорида натрия (NaCl), приняв плотность раствора равной 1 г/см3.
Решение задачи
Вычислим массу раствора хлорида натрия по формуле, устанавливающей связь между массой и объемом:
![]()
Получаем:
m = 1000 мл ∙ 1 г/мл = 1000 (г).
Найдем массу хлорида натрия (NaCl), содержащегося в 1 л раствора, для этого составим пропорцию:
в 100 г раствора содержится 1,17 г NaCl
в 1000 г раствора содержится ![]() г NaCl
г NaCl
Откуда:
![]()
Учитывая, что молярная масса хлорида натрия (NaCl) равна 58,5 г/моль, рассчитаем химическое количество хлорида натрия (NaCl), используя формулу, устанавливающую связь между химическим количеством вещества и массой:
![]() Получаем:
Получаем:
![]()
Из уравнения диссоциации хлорида натрия (NaCl) (отмечу, что соли в разбавленных растворах диссоциируют полностью):
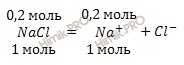 следует, что при диссоциации 0,2 моль хлорида натрия (NaCl) образуется 0,2 моль ионов натрия (Na+).
следует, что при диссоциации 0,2 моль хлорида натрия (NaCl) образуется 0,2 моль ионов натрия (Na+).
Найдем молярную концентрацию ионов натрия по формуле:
![]()
Получаем:
![]()
Ответ: концентрацию ионов натрия 0,2 моль/л.
