Сколько миллилитров 96%-ного (по массе): раствора серной кислоты (H2SO4) (р = 1,84 г/мл) нужно взять для приготовления 1 л раствора с молярной концентрацией эквивалента 0,25 моль-экв/л?
Решение задачи
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, найдем молярную массу эквивалента серной кислоты (H2SO4) по формуле:
![]()
Напомню то, что молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Получаем:
![]()
![]()
Фактор эквивалентности (fэкв) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Найдем сколько серной кислоты (H2SO4) (в г) потребуется для приготовления 1 л раствора серной кислоты (H2SO4) с молярной концентрацией эквивалента 0,25 моль-экв/л. Для расчета будем использовать формулу нахождения нормальной концентрации раствора:
![]()
Напомню, что под нормальной концентрацией (молярной концентрацией эквивалента) понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N».
Рассчитаем массу 0,25 н серной кислоты (H2SO4) по формуле:
![]()
Получаем:
m (H2SO4) = 0,25 ∙ 49 ∙ 1 = 12,25 (г).
Следовательно, в 1 л 0,25 н раствора серной кислоты (H2SO4) содержится 12,25 г серной кислоты (H2SO4).
Используя формулу нахождения массовой доли растворенного вещества:
![]()
выразим массу раствора серной кислоты (H2SO4):
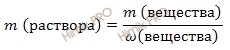
Получаем:
m (раствора H2SO4) = 12,25 г/ 0,96 = 12,76 (г).
Если раствор 96-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,96.
Вычислим объем раствора серной кислоты (H2SO4), который потребуется для приготовления 1 л раствора молярной концентрацией эквивалента 0,25 моль-экв/л. Будем использовать формулу, устанавливающую связь между объемом и массой раствора:
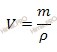
Получаем:
V (раствора H2SO4) = 12,76 /1,84 = 6,94 (мл).
Ответ:
объем раствора серной кислоты равен 6,94 мл.

Спасибо!
Пожалуйста!
Спасибо вам Ольга по подобию этой задачи решил свою все описано просто и понятно.Спасибо
Пожалуйста, Brandy!
спасибо вам большое! Вы мне очень помогли)
Farhat, пожалуйста