Сколько грамм кислорода (O2) образуется при полном разложении 13,6 грамм пероксида водорода (H2O2) и какой объем при нормальных условиях займет эта масса кислорода (O2)?
Решение задачи
Запишем реакцию разложения пероксида водорода (H2O2):
![]()
Рассчитаем молярные массы пероксида водорода (H2O2) и кислорода (O2):
M (H2O2) = 2 + 2 ∙ 16 = 34 (г/моль),
M (O2) = 2 ∙ 16 = 32 (г/моль).
По уравнению реакции найдем массу кислорода (O2), который образуется при полном разложении 13,6 грамм пероксида водорода (H2O2):
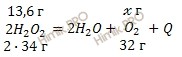
при разложении 68 г пероксида водорода (H2O2) образуется 32 г O2
при разложении 13,6 г пероксида водорода (H2O2) образуется ![]() г O2
г O2
Откуда:
![]()
Учитывая, что кислорода (O2) – газ, вычислим объем кислорода (O2), по формуле перерасчета, устанавливающей связь между массой и объемом газа:
![]()
Получаем:
V (O2) = 6,4 ∙ 22,4/32= 4,48 (л).
Ответ:
масса кислорода равна 6,4 грамма,
объем кислорода равен 4,48 литра.
