Какую массу меди (Cu) можно растворить при действии 250 миллилитров раствора азотной кислоты (HNO3) с концентрацией 60 % (плотность 1,4 г/см3). Какой газ при этом выделяется?
Решение задачи
Составим уравнения реакции взаимодействия меди с концентрированной азотной кислотой (HNO3):
![]()
При взаимодействии меди с концентрированной азотной кислотой (HNO3) выделяется бурый газ (оксид азота IV).
Рассчитаем массу раствора азотной кислоты (HNO3) по формуле, устанавливающей связь между массой и объемом:
![]()
Получаем:
m (раствора HNO3) = 250 ∙ 1,4 = 350 (г).
Используя формулу нахождения массовой доли растворенного вещества:
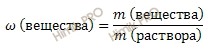 выразим массу вещества:
выразим массу вещества:
![]() Получаем:
Получаем:
m (вещества HNO3) = 350 ∙ 0,6 = 210 (г).
Если раствор 60-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,6.
Учитывая, что молярные массы азотной кислоты (HNO3) и меди (Cu) соответственно равны 63 г/моль и 63,5 г/моль, по уравнению реакции рассчитаем, сколько грамм меди (Cu) можно растворить в концентрированной азотной кислоте (HNO3):
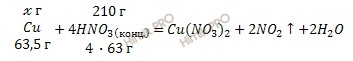
в 252 г HNO3 можно растворить 63,5 г Cu
в 210 г HNO3 можно растворить ![]() г Cu
г Cu
Откуда:
![]()
Следовательно, масса меди (Cu), которую можно растворить в концентрированной азотной кислоте (HNO3) равна 52,9 грамма.
Ответ:
масса меди 52,9 грамма.
