Записать реакции электролиза на инертных электродах и вычислить массу вещества, полученного на катоде и объем газа, выделившегося на аноде, при электролизе раствора соли нитрата серебра (AgNO3), если время электролиза 20 минут, а сила тока I=2А, если выход по току Вт=100%. Какие вещества будут выделяться на электродах при замене инертного анода на металлический (Ag)?
Решение задачи
Электролиз раствора соли нитрата серебра (AgNO3):
(-) К: Ag+, H2O.
(+) А: NO3— , H2O.
Катионы металла (Ag+), имеющие большое значение ϕ0 при электролизе полностью восстанавливаются. Следовательно:
(-) К: Ag+ + e—= Ag0;
(+) A: 2H2O — 4e— = O2↑+4H+
Анион NO3— неокисляем. Суммарное уравнение электролиза раствора соли нитрата серебра (AgNO3):
![]()
Итак, в ходе электролиза раствора соли нитрата серебра на инертных электродах будут выделяться серебро (на катоде) и кислород (на аноде).
Найдем массу серебра, полученного на катоде согласно закону Фарадея. Закон Фарадея выражается следующей формулой:
![]()
Где:
m — масса образовавшегося на электродах или подвергшегося превращению вещества, г;
Мэ — его эквивалентная масса, г/ моль;
I — сила тока, А (ампер);
t — время, с;
F — число Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Учитывая, что эквивалентная масса серебра (Ag+) равна 108 г/моль (смотри таблицу Менделеева), следовательно, его эквивалентная масса равна 108 г/моль, получаем:
m (Ag) = 108 ⋅ 2 ⋅ 1200 /96500 = 2,69 (г).
II закон Фарадея. При прохождении одинакового количества электричества через растворы (расплавы) различных электролитов массы (объемы) выделяющихся веществ пропорциональны их эквивалентным массам (объемам).
Получаем:
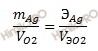
Откуда:
![]()
Так как масса серебра равна 2,69 г; Vэ(O2) = 5,6 л/моль; Э (Ag) = M (Ag) / n = 108 /1 = 108 г/моль (n -количество электронов, принимающих участие в анодном процессе).
V (O2) = 2,69 ⋅ 5,6 /108 = 0,14 (л)
Ответ:
масса серебра 2,69 грамма,
объем кислорода 0,14 литра.
При замене инертного анода на серебряный, на аноде становится возможным протекание еще одного окислительного процесса — растворение серебра, из которого сделан анод:
(+) А: Ag0 — e—= Ag+
Этот процесс характеризуется более низким значение потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе раствора соли нитрата серебра (AgNO3) с серебряным анодом на аноде происходит реакция окисления серебра (Ag), а в анодном пространстве будет накапливаться AgNO3.
Суммарная электродная реакция выразится уравнением в ионном виде:
Ag0 + Ag+ = Ag+ + Ag0
Так как ионы сокращаются, то составить молекулярное уравнение электролиза раствора соли нитрата серебра (AgNO3) невозможно. Это означает, что электролиз раствора соли нитрата серебра (AgNO3) с анодом из серебра (Ag) сводится к переносу серебра с анода на катод.
